IKATAN DAN UNSUR KIMIA
KLASIFIKASI IKATAN
Jari-jari
atom, sudut ikatan, dan elektron valensi atom atau ion yang menyusun senyawa
menentukan ikatan, struktur, reaksi dan sifat fisik senyawa. Sangat diinginkan
bahwa sifat kimia senyawa yang dikenal dan senyawa baru dapat dijelaskan dan
diprediksikan dengan menggunakan parameter universal yang khas untuk
unsur-unsur penyusunnya. Kimia anorganik telah berkembang seiring dengan
penemuan senyawa baru dan modus ikatan baru. Oleh karena itu, sangat penting
untuk mengetahui modus ikatan, faktor geometrik dan elektronik yang menentukan
ikatan, dan mempelajari konsep dasar teori orbital molekul.
Klasifikasi ikatan Ikatan yang menggunakan pasangan
elektron untuk mengikat atom A dan B disebut ikatan kovalen, dan ditulis
sebagai A-B atau A:B. Karena ada dua pasang elektron yang terlibat dalam ikatan
ganda dan tiga pasang di ikatan rangkap tiga; ikatan-katan itu ditandai
berturut-turut dengan A=B, A≡B atau A::B, A:::B. Ikatan kovalen sangat
sederhana, namun merupakan konsep yang sangat bermanfaat. Konsep ini diusulkan
oleh G. N. Lewis di awal abad 20 dan representasinya disebut struktur Lewis.
1. Ikatan
Kimia
Antara dua atom atau lebih dapat saling
berinteraksi dan membentuk molekul. Interaksi ini selalu disertai dengan
pelepasan energi. Adapun gaya-gaya yang menahan atom-atom dalam molekul
merupakan suatu ikatan yang dinamakan ikatan kimia. Ikatan kimia terbentuk
karena unsur-unsur cenderung membentuk struktur elektron stabil. Pada tahun
1916, Walter Kossel dan Gilbert Lewis menyatakan bahwa terdapat
hubungan antara stabilnya gas mulia dengan cara atom berikatan. Mereka
mengemukakan bahwa jumlah elektron terluar dari dua atom yang berikatan akan
berubah sedemikian rupa sehingga susunan kedua elektron kedua atom tersebut
sama dengan susunan gas mulia. Kecenderungan atom-atom untuk memiliki struktur
atau konfigurasi elektron gas mulia atau 8 elektron pada kulit terluar
disebut kaidah oktet. Elektron yang berperan dalam reaksi
kimia yaitu elektron pada kulit terluar atau elektron valensi. Elektron valensi
menunjukan kemampuan suatu atom untuk berikan dengan atom lain.
2.
Jenis-jenis Ikatan Kimia
Secara umum, ikatan kimia dapat dibagi menjadi 2 jenis
yaitu ikatan antar atom dan ikatan antara molekul.
- -
Ikatan antar atom
a.
Ikatan Elektrovalen atau Ion
Ikatan ion terbentuk akibat adanya melepas
atau menerima elektron oleh atom-atom yang berikatan. Atom-atom yang melepas
elektron menjadi ion positif (kation) sedangkan atom-atom yang menerima elektron
menjadi ion negatif (anion). Ikatan ion biasanya disebut ikatan elektrovalen.
Senyawa yang memiliki ikatan ion disebut senyawa ionik. Senyawa ionik biasanya
terbentuk antara atom-atom unsur logam dan nonlogam. Atom unsur logam cenderung
melepas elektron membentuk ion positif, dan atom unsur nonlogam cenderung
menangkap elektron membentuk ion negatif.
Perhatikan ilustrasi dibawah ini:
 |
| ikatan ion pada senyawa NaCl |
Bila ditulis menggunakan persamaan kimia menjadi
seperti:
Di dalam senyawa, ion positif dan negatif tersusun
dalam jumlah tertentu. Sebagai contoh senyawa NaCl yang berbentuk Kristal sebenarnya
membentuk struktur kubus. Tiap-tiap iom Na+ dikelilingi oleh ion Cl- sejumlah 6 ion.
Sifat-sifat ikatan ionik
adalah:
- Senyawa
ion berupa elektrolit
- Biasanya
zat padat yang memiliki titik leleh yang tinggi
- Tidak
larut dalam larutan pelarut organik tetapi larut dalam pelarut air
b. Ikatan Kovalen
Ikatan kovalen merupakan ikatan kimia yang terbentuk dari
pemakaian elektron bersama oleh atom-atom pembentuk ikatan. Ikatan kovalen
biasanya terbentuk dari unsur-unsur nonlogam. Dalam ikatan kovalen, setiap
elektron dalam pasangan tertarik ke dalam nukleus kedua atom. Tarik menarik
elektron inilah yang menyebabkan kedua atom terikat bersama.
Ikatan kovalen terjadi ketika masing-masing atom dalam ikatan
tidak mampu memenuhi aturan oktet, dengan pemakaian elektron bersama dalam
ikatan kovalen, masing-masing atom memenuhi jumlah oktetnya. Hal ini mendapat
pengecualian untuk atom H yang menyesuaikan diri dengan konfigurasi atom dari
yang tidak terlibat dalam ikatan kovalen disebut elektron bebas. Elektron bebas
ini berpengaruh dalam menentukan bentuk dan geometri molekul.
c. Ikatan
Kovalen Koordinat
Ikatan kovalen koordinat merupakan ikatan kimia yang
terjadi apabila pasangan elektron bersama yang dipakai oleh kedua atom
disumbangkan oleh salah satu atom saja. Sementara itu atom yang lain hanya
berfungsi sebagai penerima elektron berpasangan saja.
Syarat-syarat terbentuknya ikatan kovalen koordinat:
-
Salah satu atom memiliki
pasangan elektron bebas
-
Atom yang lainnya
memiliki orbital kosong
- Susunan ikatan kovalen
koordinat sepintas mirip dengan ikatan ion, namun kedua ikatan ini berbeda oleh
karena beda keelektronegatifan yang kecil pada ikatan kovalen koordinat
sehingga menghasilkan ikatan yang cenderung mirip kovalen.
d. Ikatan Logam
Ikatan logam merupakan
salah satu ciri khusus dari logam, pada ikatan logam ini elektron tidak hanya
menjadi milik satu atau dua atom saja, melainkan menjadi milik dari semua atom
yang ada dalam ikatan logam tersebut. Elektron-elektron dapat terdelokalisasi
sehingga dapat bergerak bebas dalam awan elektron yang mengelilingi atom-atom
logam. Akibat dari elektron yang dapat bergerak bebas ini adalah sifat logam
yang dapat menghantarkan listrik dengan mudah. Ikatan logam ini hanya ditemui
pada ikatan yang seluruhnya terdiri dari atom unsur-unsur logam semata.
Sifat-sifat umum ikatan logam:
- Penghantar listrik dan panas yang baik
- Keras, mudah ditempa dan ditarik.
- Titik lebur dan titik didih tinggi
- Mengkristal dengan bilangan koordinasi
tinggi, yaitu 12 atau 14 Sifat-sifat diatas tidak dapat dijelaskan dengan
ikatan ion atau kovalen, hingga ikatan yang khusus, yang disebut ikatan logam.
- Ikatan antara molekul
a.
Ikatan Hidrogen
Ikatan hidrogen merupakan gaya tarik menarik antara atom H dengan
atom lain yang mempunyai keelektronegatifan besar pada satu molekul dari
senyawa yang sama. Ikatan hidrogen merupakan ikatan yang paling kuat
dibandingkan dengan ikatan antar molekul lain, namun ikatan ini masih lebih
lemah dibandingkan dengan ikatan kovalen maupun ikatan ion.
Ikatan hidrogen ini terjadi pada ikatan antara atom H dengan atom
N, O, dan F yang memiliki pasangan elektron bebas. Hidrogen dari molekul lain
akan bereaksi dengan pasangan elektron bebas ini membentuk suatu ikatan
hidrogen dengan besar ikatan bervariasi. Kekuatan ikatan hidrogen ini
dipengaruhi oleh beda keelektronegatifan dari atom-atom penyusunnya. Semakin
besar perbedaannya semakin besar pula ikatan hidrogen yang dibentuknya
Kekuatan ikatan hidrogen ini akan mempengaruhi titik didih dari
senyawa tersebut. Semakin besar perbedaan keelektronegatifannya maka akan
semakin besar titik didih dari senyawa tersebut. Namun, terdapat pengecualian
untuk H2O yang memiliki dua ikatan hidrogen tiap
molekulnya. Akibatnya, titik didihnya paling besar dibanding senyawa dengan
ikatan hidrogen lain, bahkan lebih tinggi dari HF yang memiliki beda
keelektronegatifan terbesar.
b. Ikatan Van Der Walls
Gaya Van Der Walls dahulu dipakai untuk menunjukan semua jenis
gaya tarik menarik antar molekul. Namun kini merujuk pada gaya-gaya yang timbul
dari polarisasi molekul menjadi dipol seketika. Ikatan ini merupakan jenis
ikatan antar molekul yang terlemah, namun sering dijumpai diantara semua zat
kimia terutama gas. Pada saat tertentu, molekul-molekul dapat berada dalam fase
dipol seketika ketika salah satu muatan negatif berada di sisi tertentu. Dalam
keadaan dipol ini, molekul dapat menarik atau menolak elektron lain dan
menyebabkan atom lain menjadi dipol. Gaya tarik menarik yang muncul sesaat ini
merupakan gaya Van der Walls.
Gaya tarik Van Der Walls, tersusun dari beberapa gaya tarik antar
molekul. Gaya-gaya tersebut ialah: gaya orientasi (dalam Kiesom, 1912), gaya
induksi ( dalam Debey, 1920), dan gaya dispersi (dalam London, 1930). Bila
molekul-molekul yang membentuuk kristal molekuler mempunyai momen dipol,
seperti molekul HCl, H2O, dan NH3, maka akan terjadi gaya
tarik dipol-dipol, apabila molekul-molekul mempunyi orientasi yang tepat. Gaya
yang timbul dusebut gaya orientasi.
Gaya tarik molekul atau atom non polar dengan molekul polar cukup
besar karena adanya induksi kepada molekul atau atom yang non polar. Gaya tarik
yang terjadi disebut gaya induksi.
FAKTOR GEOMETRI
Jari-jari dan kekuatan
menarik elektron atom atau ion menentukan ikatan, struktur, dan reaksi zat
elementer dan senyawa.
1.
Jari
– jari Atomik dan Ion
a.
Jari-jari
Atom
Kerapatan
elektron dalam atom secara perlahan akan menuju, tetapi tidak pernah mencapai
nol ketika jarak dari inti meningkat. Oleh karena itu, secara ketat dapat
dinyatakan bahwa jari-jari atom atau ion tidak dapat ditentukan. Namun, secara
eksperimen mungkin untuk menentukan jarak antar inti atom. Jari-jari atomik
yang ditentukan secara eksperimen merupakan salah satu parameter atomik yang
sangat penting untuk mendeskripsikan kimia struktural senyawa. Cukup beralasan
untuk mendefinisikan jari-jari logam sebagai separuh jarak atom logam. Separuh
jarak antar atom didefinisikan juga sebagai jari-jari kovalen zat elementer.
b.
Jari-jari
Ionik
Jari-jari
ion adalah jari-jari ion atom. Ion tidak bisa hidup sendiri. Jika ion bermuatan
positif, ion ini akan bereaksi dengan ion bermuatan negatif (atau sebaliknya)
dan menjadi senyawa netral stabil. Senyawa ini disebut senyawa ion karena
terbuat dari komponen ion. Senyawa ion terdiri dari kation dan anion . Ukuran
kation lebih kecil karena kation dibentuk dengan membuang satu atau lebih
elektron dari atom. Anion besar karena memiliki elektron ekstra yang dipukul
oleh nukleus, sehingga terjadi peningkatan jarak antara nukleus dan elektron
terjauh dari awan elektron.
Ion-ion
dari unsur kimia yang sama dapat ditemukan dalam berbagai ukuran sesuai dengan
muatan listriknya. Metode yang paling umum untuk menemukan jari-jari ion adalah
kristalografi sinar-X. Sama seperti dalam jari-jari atom, jari-jari ion juga
memiliki tren dalam tabel periodik. Ketika kita bergerak ke bawah kelompok
dalam tabel periodik, jari-jari ion meningkat. Ini karena shell elektron baru
ditambahkan per setiap periode ketika kita pergi ke bawah grup. Selama suatu
periode, jari-jari ion menurun karena daya tarik positif efektif dari nukleus
meningkat secara bertahap.
2.
Entalpi Kisi
Siklus
Born–Haber adalah suatu pendekatan yang digunakan
untuk menganalisis energi
reaksi. Pendekatan ini dinamai dari dua ilmuwan Jerman
Max Born
dan Fritz Haber,
yang mengembangkan pendekatan ini pada tahun 1919. Pendekatan ini juga secara
independen dirumuskan oleh Kasimir Fajans. Siklus ini
berkaitan dengan pembentukan senyawa ionik
dari reaksi logam
(utamanya unsur Golongan I atau Golongan II) dengan halogen
atau unsur non-logam lainnya seperti oksigen.
Siklus Born–Haber digunakan terutama sebagai cara menghitung
energi kisi
(atau lebih tepatnya entalpi), yang tidak bisa diukur secara langsung. Entalpi kisi
adalah perubahan entalpi yang terlibat dalam pembentukan senyawa ionik dari ion berfasa gas (proses eksoterm), atau kadang-kadang didefinisikan sebagai energi untuk
memecah senyawa ion menjadi ion berfasa gas (suatu proses endotermik). Siklus Born–Haber menerapkan hukum Hess
untuk menghitung entalpi kisi dengan membandingkan perubahan entalpi pembentukan standar
dari senyawa ionik (dari unsur) ke entalpi yang diperlukan untuk membuat ion
berfasa gas dari unsur bebasnya.
Untuk memutuskan ion-ion bebas dari kisi membutuhkan energi
yang besar. Nilai dari energi kisi bergantung pada kekuatan ikatan ion. Kekuatan
ion berkaitan erat dengan ukuran dan muatan ion. Energi ionisasi atau potensial ionisasi, yaitu energi
yang diperlukan untuk melepaskan elektron terluar dari atom. Energi ini sangat
penting dalam pembentukan senyawa ionik. Semakin kecil energi ionisasinya, maka
senyawa yang terbentuk juga semakin mudah. Energi ionisasi ini biasanya
dimiliki oleh atom-atom logam untuk golongan IA dan IIA dalam tabel sistem
periodik.
Ketika ion-ion dalam keadaan gas bereaksi satu dengan yang
lainnya membentuk senyawa kemudian melepaskan entalpi atau mengubah nilai
entalpi, itulah yang disebut entalpi kisi. Sebagai contoh adalah pembentukan
NaCl yang biasanya melepaskan kalor ke lingkungan:
Na+ (g) + Cl - (g) ⇌ NaCl (s)
Tetapan Madelung digunakan dalam menentukan potensial elektrostatik dari ion tunggal dalam kristal dengan memperkirakan ion dengan muatan titik. Namanya diambil dari nama Erwin Madelung, seorang ahli fisika Jerman.
Energi potensial Coulomb total antar ion dalam senyawa ionik yang
terdiri atas ion A dan B adalah penjumlahan energi potensial Coulomb interaksi
ion individual. Karena lokasi ion-ion dalam kisi kristal ditentukan oleh tipe
struktur, potensial Coulomb total antar ion dihitung dengan menentukan jarak
antar ion d. A adalah tetapan Madelung yang khas untuk tiap struktur
Kristal.
Karena anion dan kation dalam padatan ion menarik satu sama lain berdasarkan
muatan lawannya, memisahkan ion memerlukan sejumlah energi. Energi ini harus
diberikan kepada sistem untuk memutuskan ikatan anion-kation. Energi yang
diperlukan untuk memutus ikatan ini untuk satu mol padatan ionik dalam kondisi standar adalah energi kisi. Interaksi elektrostatik antara ion-ion
yang bersentuhan merupakan yang terkuat dan tetapan Madelung juga akan
meningkat dengan semakin besarnya bilangan
koordinasi.
5. Aturan Jari-jari
4.
Struktur Kristal Logam
Logam adalah suatu unsur
yang mempunyai sifat-sifat seperti : kuat, liat, keras, mengkilat, dan
penghantar listrik dan panas. Sifat-sifat metal pada umumnya dapat digolongkan
atas
a.
Sifat-sifat Ekstraktif/kimia
(Chemical Properties)
Meliputi
ciri-ciri dari komposisi kimia dan pengaruh unsur terhadap metal (logam)
b.
Sifat –sifat mekanik
(Mechanical Properties)
Yang
disebut sifat mekanik ialah sifat bahan bilamana dipengaruhi gaya dari luar,
yaitu kekuatan tarik, kuat bengkok, kekerasan, kuat pukul, kuat geser, dan
lain-lain. Sering pula dimasukkan sifat teknologi dari material ialah mampu
mesin, mampu cor dan sebagainya.
c. Sifat – sifat Fisik
(Physical Properties)
Meliputi sifat logam yang
tidak dipengaruhi oleh tenaga luar, yaitu : berat jenis, daya hantar listrik
dan panas, sifat magnet, dan struktur mikro logam
-
Struktur Kristal
Logam seperti bahan lainnya, terdiri dari susunan atom-atom.
Untuk lebih memudahkan pengertian, maka dapat dikatakan bahwa atom-atom dalam
kristal logam tersusun secara teratur dan susunan atom-atom tersebut menentukan
struktur kristal dari logam. Susunan dari atom-atom tersebut disebut cell unit.
Pada temperatur kamar, besi atau baja memiliki bentuk
struktur BCC (Body Centered Cubic). Dalam hal ini cell unit dari atom-atom
disusun sebagai sebuah kubus dengan atom-atom menempati kedelapan dari sudut
kubus dan satu atom berada di pusat kubus. Pada temperatur yang tinggi, besi
atau baja memiliki bentuk struktur FCC (Face Centered Cubic). Dalam hal ini,
cell unit adalah sebuah kubus dengan atom-atom menempati kedelapan dari sudut
kubus dan atom lainnya berada pada pusat masing-masing dari enam keenam bidang
kubus. Disamping berbentuk kubus, cell unit lainnya dapat berupa HCP (Hexagonal
Close Packed), seperti halnya pada logam seng. Dalam hal ini atom-atom
menempati kedua belas sudut, atom lain menempati dua sisi dan ketiga atom lagi
menempati tengah.
Susunan atom-atom dalam struktur kristal sangat menentukan
sifat-sifat logamnya. Logam dengan struktur kristal BCC mempunyai kerapatan
atom yang lebih rendah dibandingkan logam dengan struktur kristal FCC.
Perbedaan kerapatan atom itu dapat dilihat dari jumlah bidang gesernya. Pada
struktur kristal BCC, jumlah bidang gesernya lebih sedikit dari struktur
kristal FCC, sehingga kemampuan atom-atom untuk bergeser lebih sulit. Dengan
demikian, logam dengan struktur kristal BCC membutuhkan energi lebih besar
untuk mengerakkan dislokasi. Hal ini yang menyebabkan logam dengan struktur
kristal BCC lebih sulit dibentuk jika dibandingkan logam dengan struktur
kristal FCC yang mempunyai kekuatan rendah tetapi memiliki keliatan yang tinggi
(ductility)
-
Struktur Mikro
Struktur mikro logam merupakan penggabungan dari satu atau
lebih struktur kristal. Pada umumnya logam terdiri dari banyak kristal
(majemuk), walaupun ada diantaranya hanya terdiri dari satu kristal saja
(tunggal). Tetapi logam dengan kristal majemuk memungkinkan pengembangan
berbagai sifat-sifat yang dapat memperluas ruang lingkup pemakaiannya. Dalam
logam, kristal sering disebut sebagai butiran. Batas pemisah antara dua kristal
pemisah antara dua kristal disebut batas butir
Struktur
kristal logam kebanyakan bahan logam mempunyai tiga struktur kristal:
a. kubus berpusat muka
(face-centered cubic).
b. kubus berpusat badan
(body-centered cubic).
c. heksagonal tumpukan padat
(hexagonal close-packed).
 |
| Model bola pejal sel satuan FCC |
 |
| Struktur kristal kubus berpusat badan (BCC) |
 |
| Struktur kristal heksagonal tumpukan padat (HCP) |
 |
| Rasio jari-jari kation dan anion |
Jari-jari anion rX
adalah separuh sisi polyhedral dan jarak kation di pusat polyhedral ke sudut polyhedral
adalah jumlah jari-jari kation dan anion rX+rM.
Polyhedral dalam CsCl adalah kubus, struktur NaCl adalah octahedral, dan ZnS
adalah tetrahedral. Jarak dari pusat ke sudut polyhedral adalah berturut-turut √3rX, √2 rX dan ½√6rX.
Sehingga, rasio jari-jari kation dan anion adalah are (√3rX-rX)/ rX =
√3-1 = 732 untuk CsCl, (√2rX-rX)/ rX = √2-1 = 0.414 untuk NaCl,
dan (½√6rX-rX)/ rX = ½√6-1 = 0.225 untuk ZnS.
6. Variasi Ungkapan Struktur Padatan
Banyak
padatan anorganik memiliki struktur 3-dimensi yang rumit. Ilustrasi yang
berbeda dari senyawa yang sama akan membantu kita memahami struktur tersebut.
Dalam hal senyawa anorganik yang rumit, menggambarkan ikatan antar atom,
seperti yang digunakan dalam senyawa organik biasanya menyebabkan kebingungan.
Anion dalam kebanyakan oksida, sulfida atau halide logam membentuk tetrahedral
atau oktahedral di sekeliling kation logam. Walaupun tidak terdapat ikatan
antar anion, strukturnya akan disederhanakan bila struktur diilustrasikan
dengan polihedra anion yang menggunakan bersama sudut, sisi atau muka. Dalam
ilustrasi semacam ini, atom logam biasanya diabaikan. Seperti telah disebutkan
struktur ionik dapat dianggap sebagai susunan terjejal anion. Gambar 2.12 dan
2-13 mengilustrasikan ketiga representasi ini untuk fosfor pentoksida molekular
P2O5 (= P4O10) dan molibdenum pentakhlorida MoCl5 (= Mo2Cl10). Representasi
polihedra jauh lebih mudah dipahami untuk struktur molekul besar atau padatan
yang dibentuk oleh tak hingga banyaknya atom. Namun, representasi garis ikatan
juga cocok untuk senyawa molekular.
 |
Tiga cara representasi P4O10
Tiga cara representasi Mo2Cl10
|
FAKTOR ELEKTRONIK
Fungsi gelombang elektron dalam suatu elektron disebut orbital atom.
DAFTAR PUSTAKA
Ikatan dan unsur senyawa ditentukan
oleh sifat elektronik seperti kekuatan atom-atom penyusun dalam menarik dan
menolak electron. Orbital molekul yang diisi electron valensi, susunan
geometrisnya dipengaruhi oleh interaksi elektronikantar electron non ikatan.
1.
Muatan Inti
Efektif
Muatan inti
efektif adalah muatan total dari inti yang dirasakan electron terluar. Muatan positif
inti sedikit banyak dilawan oleh electron negative bagian dalam (di bawah electron
valensi), muatan inti yang dirasakan oleh electron valensi suatu atom dengan
nomor atom Z akan lebih kecil dari muatan inti Ze. Penurunan ini disebut Konstanta Perisai (σ) dan muatan inti netto disebut dengan Muatan Inti Efektif (Zeff)
Persamaan: Zeff = Z – σ
Dengan Z adalah muatan
inti sebenarnya (nomor atomnya) dan σ
(sigma) disebut konstanta perisai
Muatan inti efektif kecerundungannya
didalam system periodic adalah semakin ke kanan dalam satu periode semakin besar,
semakin kebawah dalam satu golongan semakin kecil.
2.
Energi Ionisasi
Energi ionisasi (EI) adalah energi yang dibutuhkan
untuk memindahkan satu elektron terluar dari atom dalam keadaan gas.
EI diperlukan untuk mengatasi gaya tarik-menarik oleh inti atom yang
bermuatan positif terhadap elektron terluarnya. EI dipengaruhi oleh
muatan inti efektif dan susunan elektron dalam kulit valensinya. Umumnya muatan
inti efektif yang besar mengakibatkan pengeluaran elektron dari atom menjadi
sukar sehingga diperlukan EI yang lebih besar.
Atom Na memiliki
no.atom 11, maka konfigurasi elektronnya 2.8.1
Maka
dapat ditulis Na → Na+ + e–
Atom Na akan kehilangan elektron dan
kelebihan satu muatan positif, atau dengan kata lain atom Na berubah menjadi
ion Na+. Peristiwa yang terjadi pada atom ini diperlukan energi, karena
terjadinya perubahan kedudukan elektron.
Karena semua atom kecuali
hidrogen mempunyai lebih dari satu elektron, maka atom-atom ini juga mempunyai
lebih dari satu energi ionisasi. Bila pelepasan melibatkan elektron pertama,
disebut EI pertama, dan jika elektron kedua yang terlibat disebut
EI kedua, dan seterusnya.
E. ionisasi 1
: Na (g) + E1 → Na+ (g) +
e–
E. ionisasi 2
: Na+ (g) + E2 → Na2+ (g) +
e–
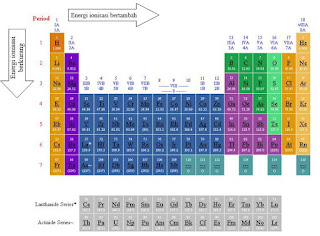
GRAFIK ENERGI IONISASI
Atom EI besar = periode kecil,
golongan besar
Atom EI kecil = periode besar,
golongan kecil
3. Afinitas
Elektron
Afinitas
electron adalah energy yang dilepaskan atau yang diperlukan saat masuknya electron
ke dalam atom atau ion dalam fase gas. Afinitas electron merupakan perubahan
entalpi ketika suatu atom pada fase gas menerima electron dari luar membentuk
suatu anion. Nilai afinitas electron dinyatakan dalam per mol atom atau mol
ion. Afinitas dapat di anggap sebagai entalpi ionisasi ion.
A
(= -∆Heg)
KE-ELEKTRONEGATIFAN
1. L.PAULING
Ke-elektronegatifan
merupakan parameter paling fundamental yang mengungkapkan secara numerik
kecerundungan atom untuk menarik electron dalam molekul.
Besarnya
keelektronegatifan dapat diukur dengan menggunakan skala Pauling. Harga skala Pauling berkisar antara 0,7 – 4,0. Skala
Pauling justifikasinya paling dekat yang mendefinisikan besaran kuantitatif
karakter ion ikatan.
2. A.L.
Allerd dan E.G. Rochow
Ke-elektronegatifan merupakan medan listrik
dipermukaan atom. Mereka menambahkan konstanta untuk membuat
ke-elektronegatifan mereka xAR sedekat
mungkin dengan nilai Pauling dengan menggunakan r (jari-jari) ikatan kovalen atom. Unsur-unsur dengan jari-jari
kovalen yang kecil dan muatan inti
efektif yang besar memiliki ke-elektronegatifan yang besar.
3. R.
Mulliken
Ke-elektronegatifan sebagai rata-rata
energy ionisasi I dan afinitas electron A.
Persamaan :
Energi ionisasi adalah energi eksitasi dari HOMO dan afinitas
elektron adalah energi penambahan electron ke LUMO. Sehingga ke-elektronegatifan
adalah rata-rata energi HOMO dan LUMO.
ORBITAL MOLEKULFungsi gelombang elektron dalam suatu elektron disebut orbital atom.
Karena kebolehjadian menemukan elektron dalam orbital
molekul sebanding dengan kuadrat fungsi gelombang dan peta electron Nampak seperti
fungsi gelombang.
Suatu gelombang fungsi
mempunyai daerah beramplitudo positif dan negatif yang disebut cuping (lobes)
Syarat pembentukan orbital :
1. Cuping orbital atom
penyusunannya cocok untuk tumpang tindih
2. Tanda positif atau
negatif cuping yang bertumpang tindih sama
3. Tingkat energi orbital-orbital atomnya dekat.
DAFTAR PUSTAKA
Ambarsari,
Novi. 2019. Ikatan Kimia (Ikatan Ion,
Ikatan Logam, Ikatan Kovalen). https://www.siswapedia.com/ (Diakses: Jumat, 13 September 2019)
Baru, Orde. 2016. Ikatan Kimia. http://makalahkimiaanorganikkelompok.blogspot.com/2016/
(Diakses: Jumat, 13 September 2019)
Sinurat, Rosanni. 2015. Ikatan Kimia. https://rosannisinurat.blogspot.com/ (Diakses:
Sabtu, 14 September 2019)
Oleh:
Nama :
Winda Wongso
NIM :
C1061191024
Prodi :
Ilmu dan Teknologi Pangan B
UNIVERSITAS TANJUNGPURA PONTIANAK




















Keren qaqa
BalasHapusmantap kakak!!!!
BalasHapusWahhh blognya sangat bermanfaat kak 👍🏻👍🏻
BalasHapusBaguss Kakk
BalasHapusKeren kakk👍👍
BalasHapuswaaah keren banget kakk, sangat membantu akuuu
BalasHapusmantul
BalasHapusBagus kk
BalasHapusMantep
BalasHapusSangat bermanfaat
BalasHapusGooood
BalasHapus👍👍👍
BalasHapus⭐⭐⭐⭐⭐
BalasHapusBagus Windra
BalasHapusNtaps
BalasHapusMantep
BalasHapusBagus👍
BalasHapusSangat bermanfaat 💯
BalasHapus